2022年1月14日,来自美国拉霍亚免疫学研究所的Klaus Ley团队在Science杂志上发表了一篇题为Olfactory receptor 2 in vascular macrophages drives atherosclerosis by NLRP3-dependent IL-1 production 的文章,研究人员检测到小鼠血管巨噬细胞表达嗅觉受体Olfr2和所有相关的运输和信号分子:在人和小鼠的血浆中含有一种能够激活NLRP3并诱导人和小鼠巨噬细胞分泌IL-1β的脂质过氧化产物——辛醛,其浓度足以激活Olfr2和人类直系同源嗅觉受体OR6A2,提高辛醛水平会加剧动脉粥样硬化,反过来如果敲除Olfr2则能显着减少动脉粥样硬化斑块。因此,这项研究表明抑制OR6A2可能为预防和治疗动脉粥样硬化提供有前景的策略。
研究人员通过对进行西式饮食(western diet, WD)2周后的Apoe-/- 小鼠主动脉qRT-PCR分析发现,Olfr2表达增加,而共聚焦显微镜和FACS显示Olfr2蛋白在约30%的血管巨噬细胞 (Mφ) 中表达。类似的,人类颈动脉内膜切除术样本的BiKE(Biobank of Karolinska Endarterectomy)数据集显示OR6A2、GNAL、CNGA1、RTP1和ADCY3等的表达,且OR6A2的mRNA表达水平随斑块巨噬细胞含量的增加而增加。Toll样受体4(Toll-like receptor 4, TLR4)配体在动脉粥样硬化中具有已知作用【4】,研究人员观察到血管Mφ中Olfr2、Rtp1和Rtp2的表达在用TLR4激动剂LPS处理后显着增加,并在辛醛处理后进一步增强。
研究人员接着用辛醛处理小鼠骨髓来源的巨噬细胞(BMDM)并进行RNA-seq发现,Olfr2可以激活氧化应激途径,辛醛引发Olfr2介导的线粒体和细胞溶质ROS的产生,而ROS可以触发NLRP3炎性小体的形成和激活,NLRP3依赖性caspase-1直接切割和激活IL–1β,并间接导致IL-1α的释放【5-7】。IL-1β和IL-1α蛋白的释放随着辛醛剂量的增加而增加,却能被Olfr2抑制剂柠檬醛所抑制,而敲除Olfr2或Nlrp3则能显着降低大约80%的IL-1β和IL-1α释放。此外,接受Olfr2-/-小鼠骨髓并喂食高胆固醇饮食8周的Ldlr-/- 小鼠(HCD喂食Ldlr-/- 小鼠以诱导动脉粥样硬化)的血管巨噬细胞显示辛醛处理后没有钙流。为了进一步探索在人类巨噬细胞(hMDM)中是否也存在这些变化,研究人员测量了hMDM中响应LPS+辛醛的Ca2+通量,Ca2+通量可以被Olfr2抑制剂柠檬醛完全消除。hMDM可以响应LPS+辛醛分泌IL-1β和IL-1α,如果用siRNA敲低OR6A2则减少IL-1β的分泌。
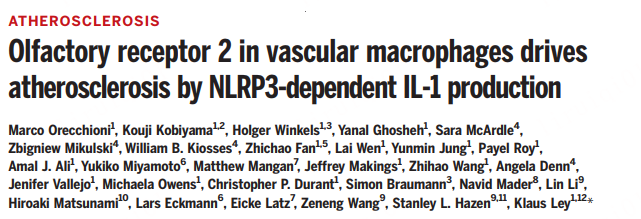
接下来,研究人员在动脉粥样硬化的Apoe-/-主动脉中检测到辛醛,与总胆固醇、非高密度脂蛋白胆固醇、低密度脂蛋白和甘油三酯显着正相关,提示辛醛可能与小鼠和人类动脉粥样硬化有关。为了直接测试辛醛在体内的影响,研究人员使用了三种小鼠模型:用Olfr2-/-或Rtp1/2dKO骨髓重建的Ldlr-/-小鼠;接受WT骨髓的Ldlr-/-小鼠;用辛醛处理的Apoe-/-小鼠。其中,喂食WD 4周的Apoe-/-小鼠随后注射辛醛后,使得主动脉弓和根本横截面的病变大小增加了一倍以上,且能诱导血浆中TNF和IL-1β水平的增加。用柠檬醛处理后,可以减少约40%的病变大小,说明辛醛可以诱导Olfr2的激活从而加剧动脉粥样硬化。而在用Olfr2-/-或Rtp1/2dKO骨髓重建的Ldlr-/-小鼠中,喂食HCD并用辛醛处理后,病变大小相对于WT骨髓重建的小鼠而言小约50%。
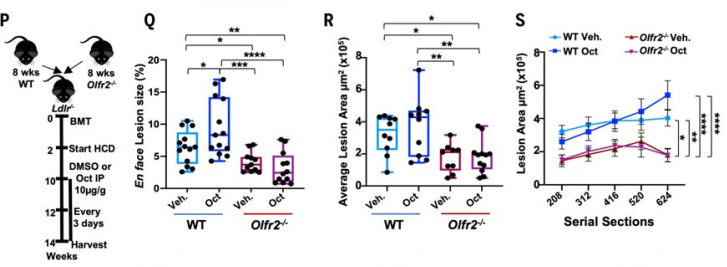
总的来说,这项研究表明Olfr2和人类直系同源嗅觉受体OR6A2作为辛醛受体,与TLR4共同可诱导响应辛醛的炎症小体激活,从而导致 IL-1α和IL-1β蛋白的产生和分泌。这与其他炎性细胞因子一起,可能解释了Olfr2在动脉粥样硬化小鼠模型中的巨大影响。因此,靶向OR6A2和可能的其他OLFRs的药物样小分子可能构成治疗、预防和逆转动脉粥样硬化的新治疗靶点。同期Science配发专门评述:The scent of atherosclerosis。
原文链接:
http://doi.org/10.1126/science.abg3067
https://www.science.org/doi/10.1126/science.abn4708













